RNA修饰是指RNA转录后发生的各种共价化学变化,对基因转录后调控具有重要意义。N6-甲基腺苷(m6A)作为一种常见的RNA内部转录后修饰,其功能主要由m6A阅读蛋白(reader)执行。尽管m6A修饰在RNA稳定性、翻译调控和转运调节中扮演重要角色,但这些阅读蛋白如何选择性识别m6A修饰mRNA的具体机制仍是一个谜。在生物体中,选择性识别对于基因表达调控、代谢调控以及生命的形态和发生至关重要。这种选择性通常通过生物大分子之间及其与小分子之间的物理和化学作用来实现。例如,蛋白质、DNA、RNA分别与蛋白质、DNA、RNA和小分子之间的相互作用都能够提供底物的特异性。
前期团队成员的研究发现,ECT2通过增加蛋白酶体调节因子PTRE1和多个20S蛋白酶体亚基的转录水平,以m6A结合依赖的方式增强了蛋白酶体活性(New Phytologist, 2020)。然而,ECT2如何选择性地识别并结合这些m6A修饰的转录本仍不清楚。近日,岭南现代农业科学与技术广东省实验室、亚热带农业生物资源保护与利用国家重点实验室和华南农业大学农学院水稻基因挖掘与利用团队在Plant Communications发表题为 “Selective Recognition of PTRE1 Transcripts Mediated by Protein-protein Interaction between the RNA m6A Reader ECT2 and PTRE1”的研究论文。该研究提出了一种通过蛋白-蛋白相互作用介导阅读蛋白与m6A mRNA结合的选择机制。

研究发现,ECT2与PTRE1蛋白及其相关的20S蛋白酶体亚基之间存在物理相互作用。这种相互作用发生在核糖体上,并涉及PTRE1的N端,暗示ECT2可能结合到新生的PTRE1多肽上。此外,通过对ECT2的蛋白互作结构域的筛选和删除实验,表明ECT2的蛋白互作结构域对其结合m6A RNA底物至关重要。通过分析新引入的其他蛋白互作结构域,发现ECT2的结合底物可以通过蛋白-蛋白相互作用介导并得到扩展。这项研究不仅揭示了ECT2如何通过蛋白质-蛋白质相互作用选择性识别m6A mRNA的机制,还为理解m6A阅读蛋白在植物中的功能提供了新的视角。此外,这项研究的创新之处在于首次展示了蛋白质结合域在调控m6A阅读蛋白识别底物中的重要作用,这可能为未来通过遗传工程手段调控植物中的m6A修饰信号传递提供新的策略。
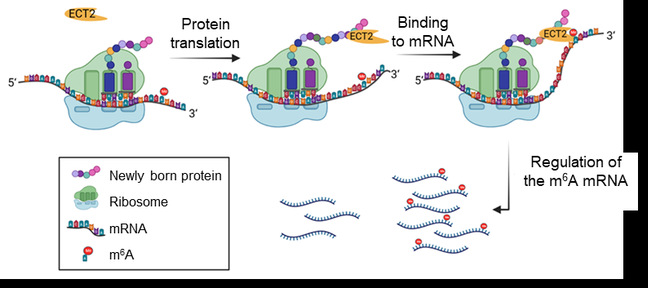
ECT2通过蛋白互作选择PTRE1等底物的识别机制
华南农业大学农学院硕士研究生杨莉和赵端木、农学院王波副教授为该论文的共同第一作者,岭南现代农业科学与技术广东省实验室/华南农业大学农学院吴健教授为该论文的通讯作者。崖州湾国家重点实验室的李家洋院士、以色列魏兹曼研究所的Gad Galili教授和Hadas Peled-Zehavi博士、东北师范大学的张志斌老师以及吴健课题组的李雪纯、秦一飞、欧阳宁、肖智丽为该论文的共同作者。本研究得到了岭南现代农业科学与技术广东省实验室及双一流学科建设项目的资助。
相关论文信息:https://doi.org/10.1016/j.xplc.2024.101043
文图/农学院



